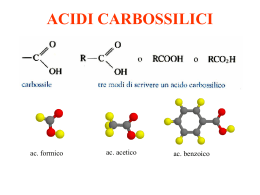
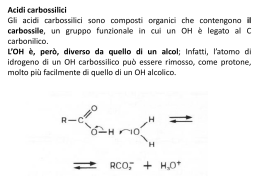
ACIDI CARBOSSILICI ac. formico ac. acetico ac. benzoico Nomenclatura Proprietà fisiche • I primi termini della serie sono liquidi incolori con odori pungenti o sgradevoli. • Composti polari e, come gli alcoli, formano legami idrogeno con se stessi o con altre molecole. • Di conseguenza: punti di ebollizione elevati, degli alcoli di pari peso molecolare. [es. l'acido acetico e l'alcol propilico hanno lo stesso peso formula (60) e bollono rispettivamente a 118°C e 97°C]. Acidità Gli acidi carbossilici si dissociano nell'acqua per formare un anione carbossilato e uno ione idronio. Occorre ricordare che, quanto più è grande il valore di Ka, o più piccolo il valore di pKa, tanto più forte è l'acido: Risonanza Perché gli acidi carbossilici sono tanto più acidi degli alcoli e dei fenoli? Soprattutto per la possibilità di delocalizzare per risonanza la carica, negli anioni che si vengono a formare. es. l'acido acetico è 1011 volte, cioè cento miliardi di volte, più acido dell'etanolo. Risonanza La carica negativa è egualmente dispersa sui due atomi di ossigeno, quindi ogni atomo di ossigeno dello ione carbossilato ne porta soltanto la metà. Nell'acido formico i due legami carbonio-ossigeno hanno lunghezze diverse, mentre nel formiato di sodio i legami carbonio-ossigeno dello ione sono identici (la lunghezza è intermedia fra un legame semplice e un legame doppio carbonio-ossigeno). Effetto induttivo della risonanza • Fra acidi carbossilici le acidità possono variare a seconda degli altri gruppi presenti nella molecola. • es. tra l'acido acetico e gli acidi mono-, di- e tricloroacetico, l'acidità aumenta di 10 000 volte. • È l'effetto induttivo dei gruppi vicini al carbossile. Salificazione Gli acidi carbossilici reagiscono con le basi forti per formare dei sali. Esempi per la nomenclatura: I derivati degli acidi carbossilici Composti nei quali l'ossidrile carbossilico è stato sostituito da altri gruppi. Esteri e ammidi sono molto diffusi in natura. Hanno la caratteristica di dare, per idrolisi, i corrispondenti acidi carbossilici. Esteri Derivano dagli acidi per sostituzione del gruppo OH con un gruppo OR e danno origine al profumo di molti frutti e fiori. La nomenclatura è analoga a quella dei sali: prima si mette il nome della componente acida, con la desinenza -ico cambiata in -ato, poi quello del radicale R del gruppo -OR. Esterificazione in ambiente acido Se un acido carbossilico e un alcol vengono riscaldati in presenza di un catalizzatore acido (di solito HCI o H,SO,), si instaura un equilibrio tra l'estere corrispondente e l'acqua. L’ossigeno dell’estere non viene dall’H2O ma dall’alcol: Meccanismo dell’esterificazione Saponificazione degli esteri L'idrolisi alcalina degli esteri si chiama saponificazione, perché un processo di questo tipo serve per preparare i saponi dai grassi La saponificazione comporta l'attacco nucleofilo da parte dello ione idrossido, che è un nucleofilo forte, sul carbonio carbonilico dell'estere. Il passaggio chiave è l'addizione nucleofila al gruppo carbonilico. Il sapone Il sapone è un sale di sodio o di potassio di un acido carbossilico alifatico a lunga catena La molecola del sapone ha una testa idrofila ionizzata negativamente ed una coda idrofoba. Le code si sciolgono nella sostanza grassa, che viene circondata formando una micella. Tutte le teste recano una carica negativa, quindi la repulsione eletttrostatica impedisce alle micelle di riaggregarsi e le mantiene in sospensione nell'acqua. Riduzione degli esteri Gli esteri possono essere ridotti ad alcoli primari dal litio alluminio idruro (LiAlH4). È possibile ridurre il solo carbonile estereo anche in presenza di un legame C=C, nella stessa molecola, che resta inalterato. Per esempio: Anidridi Derivano dagli acidi per eliminazione di acqua (condensazione) da due gruppi carbossilici. Nei confronti dei nucleofili esse sono più reattive degli esteri, ma meno reattive degli alogenuri acilici. Fra le reazioni caratteristiche dell'anidride acetica vi è anche la sintesi dell’aspirina: aspirina Ammidi Le ammidi, fra i derivati degli acidi carbossilici, sono quelli meno reattivi e sono largamente diffuse in natura. Le ammidi più importanti sono le proteine. Le ammidi hanno geometria piana e, sebbene il legame carbonio-azoto venga comunemente scritto come legame semplice, la rotazione risulta parzialmente impedita. La risonanza fa si che il legame carbonio-azoto si comporti come legame doppio. Quindi l'azoto, il carbonio carbonilico e gli atomi ad essi legati giacciono sullo stesso piano. Nelle ammidi il legame C-N misura solo 1,32A ed è molto più corto del comune legame semplice carbonio-azoto (che è di circa 1,47A). Come si può dedurre dalla forma di risonanza dipolare, le ammidi sono composti altamente polari e danno forti interazioni di tipo ponte H. La geometria delle ammidi e la possibilità di instaurare ponti H sono alla base delle strutture secondarie e terziarie di tutte le proteine e quindi delle loro funzioni specifiche. Il legame peptidico delle proteine Le proteine sono catene di aminoacidi uniti tra loro. Il gruppo carbossilico COOH di un AA ed il gruppo aminico NH2 di un altro AA reagiscono formando l’ammide, con un legame denominato peptidico). Formazione dell’ammide (legame peptidico) AA1 AA2 Si libera una molecola d’H2O Acidi grassi e alimentazione Gli acidi grassi sono i componenti fondamentali dei lipidi. Gli acidi grassi in natura non si presentano quasi mai in forma libera, la fonte di acidi grassi di gran lunga più importante negli alimenti si presenta sotto forma di trigliceridi. Acidi grassi e alimentazione Gli acidi grassi sono saturi quando presentano tutti legami semplici carbonio-carbonio, monoinsaturi o polinsaturi. Il grado di insaturazione fa cambiare le proprietà fisiche, chimiche e soprattutto biologiche. Un acido grasso è definito dal numero di atomi di carbonio (C), dal numero di doppi legami, e dalla loro posizione: in biologia si conta a che distanza è il primo doppio legame rispetto al C terminale. Acidi grassi e alimentazione I doppi legami non sono coniugati e sono quasi sempre cis (Z). In corrispondenza del doppio legame la catena si piega. Gli acidi grassi saturi sono invece lineari e le forze attrattive intermolecolari sono più efficaci e rendono il grasso solido a temperatura ambiente. L’acido linoleico (vitamina F=fatty) è essenziale, cioè l’organismo non è in grado di produrlo. Acidi grassi e alimentazione Gli acidi grassi polinsaturi, contenuti negli oli di origine vegetale vanno incontro rapidamente ad ossidazione e irrancidimento. Il processo di idrogenazione consiste nel sommare atomi di idrogeno al doppio legame. L'olio viene riscaldato a 170-180 gradi in presenza di un catalizzatore (il nichel è il più usato) e di idrogeno. L'acido grasso diventa meno soggetto a irrancidimento, cosa che permette di allungare la scadenza del prodotto. Inoltre grazie al punto di fusione più elevato la margarina si presenta solida a temperatura ambiente. Acidi grassi e alimentazione Il processo di idrogenazione produce i «grassi (o oli) vegetali parzialmente idrogenati». I grassi così ottenuti contengono ancora alcuni doppi legami ma essi sono di tipo trans nella misura del 25% - 45%, mentre in natura costituiscono solo il 5-8% del totale. Studi medici hanno dimostrato che gli acidi grassi di tipo trans sono da considerarsi più dannosi di quelli saturi, poichè alzano il livello del colesterolo LDL e non quello HDL, aumentando il rischio caerdiovascolare. Inoltre questi grassi entrano a far parte delle membrane cellulari il cui funzionamento può venire compromesso, il loro consumo è probabilmente una delle cause dell’obesità. Evitate di consumare questo tipo di alimenti!
Scarica