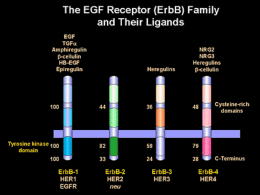
La trasformazione neoplastica è un processo che comprende una serie di mutazioni a carico di geni codificanti proteine essenziali nella proliferazione oncosoppressori oncogeni CELL DIFFERENTIATION CELL DIVISION Cell cycle and cytotoxic opportunities G2 PERIOD G1 PERIOD CELL LIFE CYCLE TIME Farmaci “selettivamente” antiproliferativi (CHROMOSOME REPLICATION) S-PHASE Agenti citotossici Alkylating Agents AntiMetabolites Mitotic Inhibitors Antibiotics Busulfan Cytosine Etoposide Bleomycin Carmustine Arabinoside Teniposide Dactinomycin Hydroxyurea Chlorambucil Floxuridine Vinblastine Daunorubicin Procarbazine Cisplatin Fluorouracil Vincristine Doxorubicin Cyclophosphamide Mercaptopurine Vindesine Mitomycin-c Ifosfamide Mitoxantrone Melphalan Methotrexate Taxoids Plicamycin Others L-asparaginase Effetti collaterali indotti dagli agenti citotossici Mucositis Alopecia Pulmonary fibrosis Nausea/vomiting Diarrhea Cystitis Cardiotoxicity Local reaction Sterility Renal failure Myalgia Myelosuppression Neuropathy Phlebitis Sviluppo clinico degli agenti citotossici Tipico effetto citotossico OBD >MTD Tossicità Dose Target Effetto antitumorale MTD OBD OBD, dose biologica ottimale; MTD, massima dose tollerata Rowinsky 2000 Efficacia della chemioterapia nelle neoplasie del colon-retto in fase metastatica 20 18 16 14 12 10 8 6 4 2 0 lo r FU w bo te FU no m FU bo lo FA FU w b ol FA o m bo lo FU M To TX m ud ex FU FU IC be st m od FU FA IR FU FA I O XA PFS OAS Bersagli Molecolari General target Specific target Agent or approach Signal transduction Growth factor receptors HER1 (EGFR) HER2 Bcr-Abl Ras Raf Tarceva Iressa Cetuximab ® Herceptin Glivec Farnesyl transferase inhibitors Antisense oligonucleotides VEGFR2 VEGF Matrix metalloproteinases Integrins SU5416 rhuMAb (Avastin ) Neovastat Vitaxin Tumour suppressor gene p53 p16 Gene therapy Gene therapy Cell cycle control Cyclin-dependent kinases Flavopiridol Angiogenesis and metastasis TM TM TM TM TM TM Sviluppo clinico degli agenti biologici a “bersaglio specifico” Agenti biologici Farmaci cytotossici OBD <MTD OBD >MTD Tossicità Dose Target Tossicità Effetto antitumorale Effetto antitumorale Dose Target Dose MTD OBD Dose OBD MTD OBD, dose biologica ottimale; MTD, massima dose tollerata Rowinsky 2000 Un esempio paradigmatico di terapia molecolare bersaglio-specifica “il recettore per l’EGF” The EGFR (erbB) family Ligands EGF TGF- Amphiregulin -cellulin HB-EGF Epiregulin No specific ligands often acts as dimer partner Heregulins NRG2 NRG3 Heregulins -cellulin Extracellular Cysteine-rich Receptor domain Membrane Intracellular Tyrosine kinase domain Wells 1999 K K K K erbB1 HER1 EGFR erbB2 HER2 neu erbB3 HER3 erbB4 HER4 Ligando EGF TGF- Amphiregulin -cellulin HB-EGF Epiregulin X Extracellulare Membrana Intracellulare dominio tirosin chinasico K erbB1 HER1 EGFR Wells 1999 K erbB2 HER2neu K K P P P omodimero HER1/HER1 K K P P P eterodimero HER1/HER2neu Nature Rev .Vol 5:341, 2005 Ruolo fisiologico dei recettori della famiglia Erb EGFR -/- Alterazioni sviluppo epitelio intestinale, epitelio polmonare, cute Neurodegenerazione talamica e corticale ErbB2-/- Alterazioni sviluppo cardiaco “heart-restricted ErbB2-inactivation” Cardiopatia dilatativa ErbB4-/- Alterazioni sviluppo cardiaco/neurale Neuregulina 1-/- Alterazioni sviluppo cardiaco Espressione dell’EGFR nei tumori umani Tumore Espressione Prognosi Rischio di metastasi Colon-retto 25-77% avversa aumentato Testa-collo 95-100% DFS, OAS Pancreas NSCLC 30-89% 40-80% OAS Rene Vescica Ovaio 50-90% 30-48% 35-70% OAS aumentato EGFR signal transduction in tumor cells Ligand EGFR K PI3-K EGFR-TK K pY pY pY GRB2 SOS RAS RAF STAT3 PTEN AKT MEK Gene transcription Cell cycle progression MAPK PP Proliferation / maturation DNA Myc JunFos Myc Cyclin D1 Cyclin D1 Survival (anti-apoptosis) Chemotherapy / Metastasis radiotherapy Angiogenesis resistance Perchè inibire le funzioni dell’EGFR? L’attivazione dell’EGFR promuove la crescita e la sopravvivenza delle cellule tumorali L’espressione o l’iperespressione è un evento comune in numerosi tipi di neoplasie solide. Tale espresssione è generalmente associata ad un peggioramento della prognosi Pertanto, l’inibizione funzionale dell’EGFR rappresenta un approccio razionale nel trattamento delle neoplasie umane Strategies to inhibit EGFR signaling Immune effector cell Anti-EGFR mAbs (eg cetuximab) Anti-ligand mAbs Bispecific Abs Ligand / toxin conjugate Nucleus EGFR tyrosine kinase inhibitors (EGFR-TKIs) (gefitinib,erlotinib) Adapted from Noonberg & Benz 2000 Inibitori dell’attività TK dei recettori della famiglia dell’EGF Agente Molecole/Legame Specificità Neoplasie Fase erlotinib anilinchinazolinico reversibile HER1 TK NSCLC, HN, mammella,ovaio, prostata, pancreas, colon, glioma Appr. gefitinib anilinchinazolinico reversibile HER1 TK NSCLC, HN, mammella,ovaio, prostata, pancreas, colon, glioma Appr. EKR-569 3-cianochinolone irreversibile HER1/2 TK NSCLC, mammella, altre neoplasie con erbB alterato 1/2. CI-1033 anilinchinazolinico irreversibile HER1-4 TK NSCLC, mammella, altre neoplasie con erbB alterato 1/2. lapatinib 6-tiazolilchinazolinico reversibile HER1/2 TK Mammella, neoplasie con erbB alterato 3 Cetuximab (C225) MAbs Ligando K K Trasduzione del segnale IgG1 MAb (chimerico) Legame specifico all’EGFR e ai suoi eterodimeri Alta affinità per l’EGFR (1 log maggiore del ligando naturale) Emivita 114 ore (75-188) Stimola l’internalizzazione del recettore Blocca la dimerizzazione del recettore, la sua attività TK, e la trasduzione del segnale. Gefitinib blocks the growth of established xenografts Gefitinib Vehicle Tumor 2.0 volume (mm3) 1.6 1.2 0.8 0.4 0.0 0 20 40 60 80 Duration of treatment (days) Wakeling et al 2002 100 120 Cetuximab inhibits the invasion of established xenografts Tumor volume (mm3) Muscle Vascular Bone Perineural 220 6/8 5/8 5/8 3/8 15 Cetuximab (0.5 mg/bi-weekly) 3/8 1/8* 1/8* 0/8* Control aNumber Locoregional invasion tissuea of mice with invasion/number of injected mice *p<0.05 Huang et al 2002 Cell cycle analysis by flow cytometry SCC-13Y cells 48 hrs G1 G1 G2M G2M S S Harari PM and Huang SM Int. J. Radiation Oncology Biol. Phys., 2001 Effetto della combinazione C225+RT linea cellulare SSC-1 Harari PM and Huang SM Int. J. Radiation Oncology Biol. Phys., 2001 Radiation-induced apoptosis Flow cytometric determination of apoptosis by DNA staining -SCC-13Y cells- sub-diploid population Harari PM and Huang SM Int. J. Radiation Oncology Biol. Phys., 2001 Fattori in grado di determinare la sensibilità all’inibizione del recettore dell’EGF La cellula deve dipendere, per la sua sopravvivenza, dall’aumentata espressione dell’EGFR (oncogene addiction) •Amplificazione genica (ErbB1 – ErbB2) •Presenza di mutazioni attivanti costitutivamente il recettore (ErbB1) tempo Amplificazione genica Vantaggio selettivo (EGF-R) (EGF-R) Iper-espressione temporanea (EGF-R) FISH Sito ATP 25 -28 Dominio regolatorio 21 -24 C-Lobe 18 -20 N-Lobe Regione transmembrana 17 13 -16 8 - 12 5-7 2- 4 Dominio extracellulare Dominio TK •Mutazione puntiformi esone 21 (L858R) (39%) •Delezione esone 19 (46%) •Mutazione puntiformi esone 20 (T790M) Fattori in grado di determinare la sensibilità all’inibizione del recettore dell’EGF La cellula deve dipendere, per la sua sopravvivenza, dall’aumentata espressione dell’EGFR (oncogene addiction) Adeguati livelli d’inibizione dell’EGFR •dose •farmacocinetica •tipo d’inibitore usato Fattori in grado di determinare la sensibilità all’inibizione del recettore dell’EGF La cellula deve dipendere, per la sua sopravvivenza, dall’aumentata espressione dell’EGFR (oncogene addiction) Adeguati livelli d’inibizione dell’EGFR •dose •farmacocinetica •tipo d’inibitore usato Alterazioni del pathway a valle dell’ EGFR (es. mutazioni attivanti K-ras, iperespressione proteine ciclo cellulare) X X K K Inibitore TK P P P K K Inibitore TK P P P X X Ciclina D1 Ciclina D1 Ciclina D1 proliferazione proliferazione proliferazione K K P P P X L’iperespressione della ciclina D1 è associata a resistenza relativa nei confronti d’inibitori dell’attività TK dell’EGFR Kalish, L. H. et al. Clin Cancer Res 2004;10:7764-7774 Copyright ©2004 American Association for Cancer Research Mutazioni dell’esone 2 del K-ras correla con la resistenza al cetuximab nei tumori del colon-retto 11% 51% 5 RP + 22 SD Khambata-Ford, S. et al. J Clin Oncol; 25:3230-3237 2007 Copyright © American Society of Clinical Oncology Bokemeyer C et al., JCO 2009 Come possiamo migliorare l’efficacia dei trattamenti a bersaglio molecolare ? • Strategie terapeutiche che contemplino l’utilizzo di diversi farmaci a bersaglio molecolare specifico • Identificazione di fattori predittivi di risposta al trattamento con farmaci a bersaglio molecolare (es. anti-EGFR) Evidence for combining EGFR and VEGF inhibitors Interactions between EGFR and VEGF patwhays: EGFR and VEGF share common downstream signalling Endothelial cells express EGFR EGF stimulation VEGF Resistance to anti-EGFR → upregulation of pro-angiogenetic factors Ciardiello, F. et al. Ann Oncol 2006 Ciardiello, F. et al. Clin Cancer Res 2000 Tossicità cutanea farmaci inibitori di EGFR (cetuximab, erlotinib, gefitinib) Tipo Descrizione Rash acneiforme Eritema o eruzione maculare o papulare con o senza prurito, associato a desquamazione secca Xerosi Paraonichia Secchezza generalizzata della cute con fine desquamazione, fino alla comparsa di fissurazione della cute Eventi infiammatori dei tessuti che circondano l’unghia, fino alla formazione del granuloma piogenico Tronco Giorno +192 Alluce piede destro Giorno +150 Correlation of rash and survival after treatment with ERBITUX 16 Survival (months) 14 12 10 8 6 4 2 0 Study: CRC CRC CRC CRC Pancreatic SCCHN 99231 01412 BOND3 EORTC/NCI4 Abbruzzese5 Kies6 No reaction Grade 1 Grade 2 Grade 3 1. Saltz L, et al. ASCO 2001, # 7; 2. Saltz L, et al. J Clin Oncol 2004;22:1201–1208; 3. Cunningham D, et al. N Engl J Med 2004;351:337–345; 4. Van Cutsem E, et al. EORTC/NCI Geneva 2004; 5. Abbruzzese, et al. ASCO 2001. # 518; 6. Kies, et al. ASCO 2002; # 925 Overall Survival by Worst Grade of Skin Toxicity in the Panitumumab Patients 1.0 Grade 2-4 Grade 1 0.9 Survival Probability 0.8 Hazard ratio=0.61a (95% CI: 0.40, 0.95) P =.0278 0.7 0.6 0.5 0.4 0.3 0.2 0.1 0.0 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Months from Randomization Patients at risk: Grade 2-4 152 150 138 120 99 71 58 Grade 1 57 55 47 34 24 20 12 a 39 8 Hazard ratio for Grade 2-4 relative to Grade 1, stratified by ECOG and geographic region 29 5 17 4 13 3 9 2 6 0 5 0 1 0 0 0 0 0 Materiale incluso in paraffina sezioni rappresentative IHC FISH EGFR, HER2 EGFR, HER2m pMAPK, pAKT, KI-67, ….. Stratificazione x n.copie Microdissezione Estrazione DNA Mutazioni EGFR, HER2, Ki-RAS qPCR-EGFR, polimorfismo introni EGFR Decorso della malattia Franklin WA, ASCO 2005
Scarica