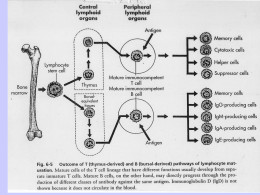
CORSO DI IMMUNOLOGIA per il corso di Laurea in biotecnologie a.a. 2005-2006 II semestre DOCENTE: Dott.ssa Vladia Monsurrò Dipartimento di patologia Sezione di immunologia Universita’ degli Studi di Verona 045 8074256 [email protected] ORARIO DELLE LEZIONI: lunedì: 4:00-5:30 giovedì 4:00-5:30 dal 20 marzo al 25 maggio 2006 aula F Facolta’ di Scienze PROGRAMMA LEZIONI Mar 21 Marzo lezione 1 Generalità sul corso Il sistema immunitario (Introduzione) Giov 23 Marzo lezione 2 Cellule e tessuti del sistema immunitario Lun 27 Marzo lezione 3 Riconoscimento dell’antigene: Molecole del Sistema Immunitario: Antigeni e anticorpi Giov 30 Marzo lezione 4 MHC (Major histocompatibility complex) Lun 3 Aprile lezione 5 MHC-Antigene: Sua captazione, processamento e presentazione. Giov 6 Aprile lezione 6 TCR-Antigeni tumorali e immunoterapia (in preparazione del talk) Lun 10 Aprile lezione 7 Maturazione, attivazione e regolazione dei linfociti: Maturazione dei linfociti ed espressione dei recettori (genetica Ig e TCR) Giov 13 Aprile lezione 8 Immunita’ e tumori Parmiani Talk (ore 17:00)-vedi volantino Giov 20 Aprile lezione 9 Attivazione segnale. linfocitaria, Lun 24 Aprile lezione 10 Attivazione dei linfociti B e produzione di Ab Giov 27 Aprile lezione 11 Tolleranza immunologica Giov 4 Maggio lezione 12 Meccanismi effettori Citochine, Immunita’ innata Lun 8 Maggio lezione 13 Meccanismi mediata Giov 11 Maggio lezione 14 Meccansimi effettori dell’immunita’ umorale Lun 15 Maggio lezione 15 Rapporti tra fisiologia e patologia Ipersensibilità concetti generali Ipersensibilità di tipo I Giov 18 Maggio lezione 16 Test prove esami-recupero Merc 7 giugno e 28 giugno ESAMI effettori trasduzione del dell’immunita’ cellulo- RICIRCOLAZIONE LINFOCITARIA (RECLUTAMENTO) Ig SUPERFAMILY Il legame tra molecole di adesione consolida l’interazione tra cellule adiacenti e potenzia il segnale specifico MHC-TCR FAMIGLIA DELLE INTEGRINE LE MOLECOLE DI ADESIONE (CAM) DEI LINFOCITI POTENZIANO LE INTERAZIONI CON LE ALTRE CELLULE E PERMETTONO LA MIGRAZIONE E IL RICIRCOLO DEI LINFOCITI - superfamiglia delle immunoglobuline - famiglia delle integrine - famiglia delle selectine - famiglia delle mucine MOLECOLE DI ADESIONE (CAM= Cell Adhesion Molecule) PERCHE’ E’ IMPORTANTE? • Per far incontrare l’antigene e il linfocita specifico • Per posizionare I linfociti specifici solo in siti di infezione L'INTERAZIONE TRA MOLECOLE DI ADESIONE MEDIA IL PASSAGGIO ATTRAVERSO GLI ENDOTELI VASCOLARI E PERMETTE IL TRAFFICO LINFOCITARIO LE CHEMOCHINE ATTIRANO I LEUCOCITI NELLE ZONE DI INFIAMMAZIONE ATTRAVERSO GLI ENDOTELI FASI DELLO STRAVASO IN UN LINFONODO DI UN LINFOCITA T VERGINE ATTRAVERSO UNA VENULA A ENDOTELIO ALTO (HEV) START Pathways of T lymphocyte recirculation. Naive T cells preferentially leave the blood and enter lymph nodes across the high endothelial venules. Dendritic cells bearing antigen enter the lymph node through lymphatic vessels. If the T cells recognize antigen, they are activated, and they return to the circulation through the efferent lymphatics and the thoracic duct, which empties into the superior vena cava, then into the heart, and ultimately into the arterial circulation. Effector and memory T cells preferentially leave the blood and enter peripheral tissues through venules at sites of inflammation. Recirculation through peripheral lymphoid organs other than lymph nodes is not shown. High endothelial venules (HEVs). B. Expression of L-selectin ligand on HEVs, stained with a specific antibody by the immunoperoxidase technique. (The location of the antibody is revealed by a brown reaction product of peroxidase, which is coupled to the antibody) The HEVs are abundant in the T cell zone of the lymph node. (Courtesy of Drs. Steve Rosen and Akio Kikuta, Department of Anatomy, University of California San Francisco.) C. A binding assay in which lymphocytes are incubated with frozen sections of a lymph node. The lymphocytes (stained dark blue) bind selectively to HEVs. (Courtesy of Dr. Steve Rosen, Department of Anatomy, University of California San Francisco.) D. Scanning electron micrograph of an HEV with lymphocytes attached to the luminal surface of the endothelial cells. (Courtesy of J. Emerson and T. Yednock, University of California San Francisco School of Medicine, San Francisco. From Rosen SD, and LM Stoolman. Potential role of cell surface lectin in lymphocyte recirculation. In Olden K, and J Parent. Vertebrate Lectins. Van Nostrand Reinhold, New York, 1987.) VENULE AD ENDOTELIO ALTO (HEV=High Endothelial Venules) I linfociti vergini circolano indiscriminatamente nei vari organi linfoidi secondari attraverso le HEV, riconoscendo le loro molecole di adesione. Migration of naive and effector T lymphocytes. A. Naive T lymphocytes home to lymph nodes as a result of L-selectin binding to its ligand on high endothelial venules, which are present only in lymph nodes. Activated T lymphocytes, including effector cells, home to sites of infection in peripheral tissues, and this migration is mediated by E- and Pselectins and integrins. In addition, different chemokines that are produced in lymph nodes and sites of infection also participate in the recruitment of T cells to these sites (not shown). B. The ligands for the principal T cell homing receptors, and the functions of these receptors and ligands, are shown. FAMIGLIA DELLE SELECTINE I RECETTORI PER GLI ANTIGENI: • IG • MHC • TCR RICONOSCIMENTO DELL’ANTIGENE : - linfociti B -linfociti T antigene in forma nativa antigene processato da cellule accessorie (cellule presentanti l’antigene ) IL LINFOCITA B E IL SUO RECETTORE PER L'ANTIGENE Linfocita B Immunoglobulina Struttura molecolare delle Immunoglobuline: i domini C e V sono tutti DOMINI IMMUNOGLOBULINICI a foglietti antiparalleli LINFOCITI T E LORO RECETTORE PER L'ANTIGENE Linfocita T citotossico o CD8+ TCR CD8 CD4 Recettore per l’antigene Linfocita T helper o CD4+ STRUTTURA DEL TCR IMMUNITA’ INNATA: fagociti e cellule NK RECETTORI PER L’ANTIGENE DELLE APC PROFESSIONISTE Macrofago: -recettore per il mannoso -recettore per glicani -recettore per LPS (CD14) -recettore Toll-simile TLR-4 Cellula dendritica: -recettore per il mannoso -recettore per LPS (CD14) -recettore Toll-simile TLR-4 Bersagli del riconoscimento del sistema immunitario innato • PAMPs= Pathogen Associated Molecular Patterns : sul microorganismo • PRRs = Pattern Recognition Receptors: sulle cellule del sistema immunitario innato PRRs: • sulla membrana o intracellulari, segnalano l’infezione (Toll-like (TLR) receptors); • Mediatori di endocitosi; • Secreti, che attivano il complemento, opsonizzano i microbi e possono legare recettori di membrana. Toll-like receptors (TLR) Sono almeno 10 quelli riconosciuti tra i mammiferi. Tutti i loro ligandi sono PAMPs derivati da tutte le maggiori classi di patogeni. L’attivazione dei TLR da parte dei prodotti microbici porta all’induzione di numerosi geni responsabili di risposte infiammatorie e immunitarie, tra cui quelli di citochine infiammatorie, chemochine, molecole effettrici antimicrobiche, molecole MHC e costimolatorie. Le APC (=Antigen Presenting Cell) “PROFESSIONISTE” presentano l’antigene processato ai linfociti T associato alle molecole MHC recettore MHC legante l’antigene processato in peptidi Cellula dendritica Macrofago Linfocita B STRUTTURA SCHEMATICA DELLE MOLECOLE MHC Catena : 44-47kD Catena : 2-microglobulina, 12kD • 2 catene polipeptidiche e • associate non covalentemente • con strutture secondarie costituite da foglietti e -eliche. STRUTTURA SCHEMATICA DELLE MOLECOLE MHC Catena : 32-34kD Catena : 29-32kD • 2 catene polipeptidiche e • associate non covalentemente • con strutture secondarie costituite da foglietti e -eliche. Le molecole MHC-I ed MHC-II completamente assemblate sono eterotrimeri, composti da: 1. una catena ; 2. una catena ; 3. il peptide antigenico nella tasca. L’espressione stabile sulla membrana cellulare richiede la presenza di tutti e tre i componenti. cellula dendritica (DC) Antigene nativo Molecole MHC Linfocita B e suoi recettori per l’antigene Linfocita T helper e suoi recettori e co-recettori per l’antigene Antigene Processato, Associato a Molecole MHC PRESENTAZIONE DELL’ANTIGENE CAPTATO DALL’ESTERNO E PROCESSATO DA PARTE DI APC PROFESSIONISTE Linfocita B Macrofago MHC-II e Antigene processato Linfocita T helper e suoi recettori e co-recettori per l’antigene Linfocita T helper e suoi recettori e co-recettori per l’antigene MHC-II e Antigene processato PRESENTAZIONE DELL’ANTIGENE CAPTATO DALL’ESTERNO E PROCESSATO DA PARTE DELLE CELLULE DENDRITICHE Cellula dendritica MHC-II Antigene processato MHC-I Antigene processato Linfocita T helper e suoi recettori e co-recettori per l’antigene Linfocita T citotossico, suoi recettori per l'antigene e co-recettori CD8 Le molecole MHC-I presentano l’ Ag ai T citotossici Le molecole MHC-II presentano l’ Ag ai T helper Gli Anticorpi ( = le immunoglobuline) • Gli Anticorpi si legano all’ antigene sia nella fase di riconoscimento che nella fase effettrice dell’immunita’ umorale. • Fase di riconoscimento: anticorpo di membrana riconosce l’antigene • Fase effettrice: l’anticorpo libero lega l’antigene e: si neutralizzano microbi o prodotti microbici tossici Si attiva il sistema del complemento Si opsonizzano gli antigeni Avviene la citotossicita’ cellulare mediata da anticorpi (immunita’ innata) o da ipersensibilita’ immediata (attivazione dei mastociti) • Dove si trovano? Nella parte fluida del sangue: siero. Nelle secrezioni mucose (IgA) Poco nel fluido interstiziale Sulle membrane dei linfociti B (e nel RE e Golgi) Tiselius e Kabat, nel 1939: gli Ab sono presenti nella frazione Gamma-globulinica delle proteine sieriche Structure of an antibody molecule. A. Schematic diagram of a secreted IgG molecule. The antigen-binding sites are formed by the juxtaposition of variable light chain (VL) and variable heavy chain (VH) domains. The heavy chain C regions end in tail pieces. The locations of complement- and Fc receptor-binding sites within the heavy chain constant regions are approximations. B. Schematic diagram of a membrane-bound IgM molecule on the surface of a B lymphocyte. The IgM molecule has one more heavy chain C region (CH) domain than IgG, and the membrane form of the antibody has C-terminal transmembrane and cytoplasmic portions that anchor the molecule in the plasma membrane. C. Structure of a human IgG molecule as revealed by x-ray crystallography. In this ribbon diagram of a secreted IgG molecule, the heavy chains are colored blue and red, and the light chains are colored green; carbohydrates are shown in gray. (Courtesy of Dr. Alex McPherson, University of California, Irvine.) STRUTTURA FONDAMENTALE DI UNA MOLECOLA DI IMMUNOGLOBULINA: • catene PESANTI • catene LEGGERE due catene leggere (isotipo k o ) due catene pesanti (isotipo oppure , , , ) ponti disolfuro che legano tra loro le due catene pesanti e ciascuna catena leggera ad una catena pesante REGIONI COSTANTI E REGIONI VARIABILI regioni VARIABILI VH CH1 VL CL regioni COSTANTI CH2 CH3 STRUTTURA FONDAMENTALE DI UNA MOLECOLA DI IMMUNOGLOBULINA VH CH1 catena leggera: -1 dominio variabile VL -1 dominio costante CL catena pesante: 1 dominio variabile VH 3 o 4 domini costanti CH, a seconda dell'isotipo VL CL CH2 CH3 Struttura molecolare degli anticorpi: Il “DOMINIO IMMUNOGLOBULINICO”è costituito da un sandwich di foglietti planari , ciascuno dei quali formato da nastri aminoacidici in configurazione -antiparallela, collegati tra loro da anse di varia lunghezza. DOMINIO IMMUNOGLOBULINICO Structure of an antibody light chain. The secondary and tertiary structures of a human Ig light chain are shown schematically. The variable (V) and constant (C) regions each independently fold into Ig domains. Each domain is composed of two antiparallel arrays of b-strands represented by the flat arrows, colored yellow and red, respectively, to form two b-pleated sheets. In the C domain, there are three and four b-strands in the two sheets. In the V domain, which is about 16 amino acid residues longer than the C domain, the two sheets are composed of five and four strands. The dark blue bars are intrachain disulfide bonds, and the numbers indicate the positions of amino acid residues counting from the amino (N) terminus. These Ig C and V domain structures are found in the extracellular portions of many other membrane proteins in the immune system, Structure of an antibody light chain. The secondary and tertiary structures of a human Ig light chain are shown schematically. The variable (V) and constant (C) regions each independently fold into Ig domains. Each domain is composed of two antiparallel arrays of b-strands represented by the flat arrows, colored yellow and red, respectively, to form two b-pleated sheets. In the C domain, there are three and four b-strands in the two sheets. In the V domain, which is about 16 amino acid residues longer than the C domain, the two sheets are composed of five and four strands. The dark blue bars are intrachain disulfide bonds, and the numbers indicate the positions of amino acid residues counting from the amino (N) terminus. These Ig C and V domain structures are found in the extracellular portions of many other membrane proteins in the immune system, Hypervariable regions in Ig molecules. A. Kabat-Wu plot of amino acid variability in Ig molecules. The histograms depict the extent of variability defined as the number of differences in each amino acid residue among various independently sequenced Ig light chains, plotted against amino acid residue number, measured from the amino terminus. This method of analysis, developed by Elvin Kabat and Tai Te Wu, indicates that the most variable residues are clustered in three "hypervariable" regions, colored in blue, yellow, and red corresponding to CDR1, CDR2, and CDR3, respectively. Three hypervariable regions are also present in heavy chains. B. Three-dimensional view of the hypervariable CDR loops in a light chain variable (V) domain. The V region of a light chain is shown with CDR1, CDR2, and CDR3 loops, colored in blue, yellow, and red, respectively. These loops correspond to the hypervariable regions in the variability plot in A. Heavy chain hypervariable regions (not shown) are also located in three loops, and all six loops are juxtaposed in the antibody molecule to form the antigen-binding surface (see Fig. 3-4). Frammento Fab di un anticorpo complessato con un antigene, legato a livello delle anse ipervariabili. Binding of an antigen by an antibody. This model of a globular protein antigen (chicken lysozyme) bound to an antibody molecule shows how the antigen-binding site can accommodate soluble macromolecules in their native (folded) conformation. The heavy chains of the antibody are colored red and the light chains are yellow, and the antigen is colored blue. (Courtesy of Dr. Dan Vaughn, Cold Spring Harbor Laboratory.) I siti combinatori per l’antigene comprendono regioni dette “ipervariabili” dette CDR (Complementarity Determining Regions), dove è concentrata la maggior parte delle differenze di sequenza tra le diverse molecole di anticorpo. La regione cerniera permette flessibilità alle molecole anticorpali La digestione delle IgG con papaina o pepsina (Porter 1962), ha permesso di costruire un modello di struttura delle Ig, perché a determinati frammenti proteolitici corrispondono Ffunzioni ben definite Proteolytic fragments of an IgG molecule. IgG molecules are cleaved by the enzymes papain (A) and pepsin (B) at the sites indicated by arrows. Papain digestion allows separation of two antigenbinding regions (the Fab fragments) from the portion of the IgG molecule that binds to complement and Fc receptors (the Fc fragment). Pepsin generates a single bivalent antigenbinding fragment, F(ab¢)2. DEFINIZIONI • Antigene=sostanza che lega in modo specifico Ig o TCR • Immunogeno= antigene che innesca una rispost aimmunitaria • L’aptene, che e’ l’antigene, per esser eimmunogeno deve essere caricato su di un carrier (macromolecola) • L’epitopo e’ la parte della macromolecola che lega l’Ab • Multivalente= molecola che presenta piu’ epitopi The nature of antigenic determinants. Antigenic determinants (shown in orange, red, and blue) may depend on protein folding (conformation) as well as on covalent structure. Some determinants are accessible in native proteins and are lost on denaturation (A), whereas others are exposed only on protein unfolding (B). Neodeterminants arise from covalent modifications such as peptide bond cleavage (C). Linfociti B: il recettore per l’antigene immunoglobulinico (Ig): • forma di membrana (BCR) • secreto (anticorpo) Le Ig di membrana sono associate al complesso IgIg, implicato nella trasduzione del segnale Membrane and secreted forms of Ig heavy chains. The membrane forms of the Ig heavy chains, but not the secreted forms, contain transmembrane regions made up of hydrophobic amino acid residues and cytoplasmic domains that differ significantly among the different isotypes. The cytoplasmic portion of the membrane form of the m chain contains only 3 residues, whereas the g3 cytoplasmic region contains 28 residues. The secreted forms of the antibodies end in C-terminal tail pieces, which also differ among isotypes: m has a long tail piece (21 residues) that is involved in pentamer formation, whereas g3 has only a short tail piece (3 residues). In this figure, the m and g3 chains are compared, but other g isotype heavy chains have structures similar to g3. Amino acids are shown in the letter code, and the last amino acid of the terminal C region domain (i.e., Cm4 or Cg3) is indicated. …è il tratto che le àncora alla membrana cellulare Changes in antibody structure during humoral immune responses. The illustration depicts the changes in the structure of antibodies that may be produced by the progeny of activated B cells (one clone) and the related changes in function. During affinity maturation, mutations in the variable (V) region (indicated by red dots) lead to changes in fine specificity without changes in constant (C) region-dependent effector functions. Activated B cells may shift production from largely membrane-bound antibodies containing transmembrane and cytoplasmic regions to secreted antibodies. Secreted antibodies may or may not show V gene mutations (i.e., secretion of antibodies occurs before and after affinity maturation). In isotype switching, the C regions change (indicated by color change from blue to orange) without changes in the antigen-binding V region. Isotype switching is seen in membrane-bound and secreted antibodies. • In base alla struttura delle regioni C della catena pesante si differenziano 5 classi (isotipi): • IgA • IgD • IgE • IgG • IgM I CINQUE ISOTIPI (O CLASSI) DELLE IMMUNOGLOBULINE CH1 CH1 CH2 CH2 CH3 CH3 CH4 IgM nella forma di membrana IgD CH1 CH1 CH2 CH3 IgG CH1 CH2 CH2 CH3 CH3 CH4 IgE IgA Il passaggio da Ig di membrana a Ig di secrezione dipende da meccanismi di SPLICING ALTERNATIVO I linfociti B maturi naive esprimono due tipi di recettore sulla superficie : IgM e IgD. La catena leggera e’ la stessa. Nel trascritto secondario l’esone VDJ viene associato alternativamente agli esoni di C o C, per SPLICING ALTERNATIVO. Isotipi immunoglobulinici in forma secreta Schema delle 4 sottoclassi Ig umane Le Ig di membrana presentano un tratto carbossiterminale più lungo rispetto a quelle secrete… Valency and avidity of antibody-antigen interactions. Monovalent antigens, or epitopes spaced far apart on cell surfaces, will interact with a single binding site of one antibody molecule. Although the affinity of this interaction may be high, the overall avidity is relatively low. When repeated determinants on a cell surface are close enough, both the antigen-binding sites of a single IgG molecule can bind, leading to a higher avidity bivalent interaction. The hinge region of the IgG molecule accommodates the shape change needed for simultaneous engagement of both binding sites. IgM molecules have 10 identical antigen-binding sites that can theoretically bind simultaneously with 10 repeating determinants on a cell surface, resulting in a polyvalent, very high avidity interaction. Immagini al microscopio elettronico a scansione di IgM e IgA in forma secreta IgM IgA Antigen-antibody complexes. The sizes of antigen-antibody (immune) complexes are a function of relative concentrations of antigen and antibody. Large complexes are formed at concentrations of multivalent antigens and antibodies that are termed the zone of equivalence; the complexes are smaller in relative antigen or antibody excess Importante nelle reazioni di immunoprecipitazione e titolazione Come si misurano • Facendo un titolo anticorpale ossia vedendo la diluizione minima in cui non si vede piu’ la formazione antigene anticorpo (molto anticorpo= alto titolo). PRODUZIONE DI ANTICORPI MONOCLONALI
Scarica