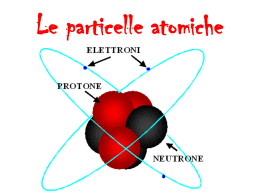
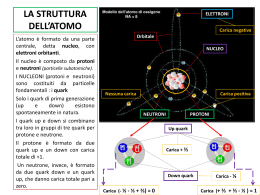
L'ATOMO ATOMO: è la più piccola parte di un elemento che ne conserva le proprietà. MOLECOLA: è la più piccola particella di una sostanza che ne conserva tutte le proprietà. Elemento chimico: è una sostanza che non può più essere scomposta in sostanze più semplici. In natura esistono 92 elementi chimici e quindi 92 tipi di atomi. Ad ogni elemento corrispondono un nome e un simbolo formato da una o due lettere. La formula chimica di una sostanza descrive in modo semplice e conciso come è fatta una molecola: essa indica quali atomi contiene e in quale numero. Composti: sono sostanze che si possono scomporre per ottenere sostanze più semplici. Risultano dalla combinazione di due o più atomi di elementi differenti. Atomo= indivisibile (dal greco) La struttura dell'atomo: - nucleo = parte centrale contenente protoni e neutroni - particelle che ruotano attorno al nucleo = elettroni I protoni e i neutroni hanno una massa quasi uguale, mentre gli elettroni hanno una massa circa 2000 volte più piccola. L'atomo è sostanzialmente vuoto. Protoni: carica elettrica positiva Neutroni: carica elettrica neutra Elettroni: carica elettrica negativa Normalmente in un atomo il numero degli elettroni è uguale al numero dei protoni, per cui l'atomo risulta elettricamente neutro. Il numero dei protoni distingue un elemento da un altro; infatti tutti gli atomi di uno stesso elemento hanno lo stesso numero di protoni. NUMERO ATOMICO (Z)=numero dei protoni (contrassegno di identità di un atomo) Numero di massa=numero dei protoni più numero dei neutroni=numero totale di particelle presenti nel nucleo. ISOTOPI= atomi di uno stesso elemento con diverso numero di neutroni. Isotopi dell'idrogeno: - idrogeno comune o prozio (1 protone) - deuterio (1 protone e 1 neutrone) - trizio (1 protone e 2 neutroni) Nell'atomo gli elettroni occupano strati diversi a partire da quello più interno; ogni strato può contenere un certo numero massimo di elettroni. Lo strato più interno ne contiene solo due, il secondo e il terzo strato possono arrivare fino a 8; quando uno strato è pieno, si passa a quello successivo. LA TAVOLA PERIODICA DEGLI ELEMENTI: Mendeleev si era accorto che, ordinando gli elementi dal più leggero al più pesante, le loro proprietà si ripetevano a intervalli regolari. Nella tavola da lui costruita ha sistemato in colonne gli elementi con proprietà simili; gli elementi sono sistemati in righe orizzontali, in ordine crescente di numero atomico. Ci sono 7 righe orizzontali dette PERIODI e 8 colonne verticali dette GRUPPI; poi si devono aggiungere gli elementi di transizione. - Gruppi=colonne verticali: elementi con ugual numero di elettroni nell'ultimo strato: hanno proprietà chimiche simili. METALLI: elementi che tendono a cedere gli elettroni esterni NON METALLI: elementi che tendono ad acquistare gli elettroni esterni SEMIMETALLI: hanno proprietà intermedie e sono disposti in diagonale dal boro all'astato GAS NOBILI: fanno parte dell'VIII gruppo e non tendono nè ad acquistare nè a cedere elettroni
Scarica