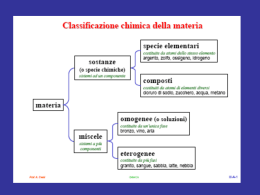
Passaggi di stato • • • • • • liquido vapore vapore liquido solido liquido liquido solido solido vapore vapore solido evaporazione condensazione fusione congelamento sublimazione solidificazione Curva di riscaldamento Tensione di vapore • H2O(l) ⇆ H2O(g) K = PH2O • La pressione di vapore (tensione di vapore) di una sostanza è la pressione esercitata dal suo vapore quando si trova in equilibrio con la fase condensata • La pressione di vapore aumenta con la temperatura Evaporazione e Ebollizione • • • • in un recipiente chiuso il liquido evapora finché la pressione (parziale) del suo gas è uguale a Peq liquido e vapore sono in equilibrio in un recipiente aperto il liquido evapora e il vapore si allontana se Peq = Patm il liquido bolle: evapora velocemente e T è costante Proprietà colligative dipendono dal numero di particelle e non dal tipo di soluto • • • • abbassamento pressione di vapore innalzamento ebullioscopico abbassamento crioscopico osmosi NaCl(aq) H 2O Hg SOLVENTE PURO EQUILIBRIO VEVAP = VCOND p0 = TENSIONE DI VAPORE DEL SOLVENTE SOLUZIONE VEVAP < VCOND NUOVO EQUILIBRIO p = TENSIONE DI VAPORE DEL SOLVENTE p < p0 X1 = n1 n1 + n2 X2 = n2 n1 + n2 (1) p = p0 X1 (p0 – p)/p0 = X2 Frazione Molare X1 + X2 = 1 0≤X≤ 1 Legge di Raoult Se anche il secondo componente è volatile : p = p01 X1 + p02 X2 ΔT = ke m Innalzamento T ebollizione quantità di soluto in mol molalità del soluto m massa di solvente in kg •Tb = kb m •se il soluto si dissocia, tenerne conto nel calcolo di m •per l'acqua kb = 0,51 Kkg / mol ΔT = ke m Abbassamento T congelamento quantità di soluto in mol molalità del soluto m massa di solvente in kg •abbassamento crioscopico •Tf = kf m •se il soluto si dissocia, tenerne conto nel calcolo di m •per l'acqua kf = 1,86 Kkg / mol Membrana semipermeabile Π=RMT Pressione osmotica =RMT • si può anche scrivere ( M = n / V ) V=nRT • simile all'equazione dei gas, con la stessa costante R PV=nRT
Scarica