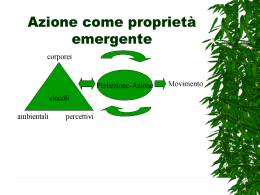
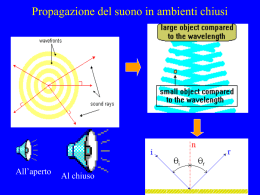
ANALISI SPETTROSCOPICA La spettroscopia si occupa dello studio dell’interazione tra la radiazione elettromagnetica e la materia (atomi e molecole). Spettro elettromagnetico Le radiazioni elettromagnetiche, cui appartiene anche la luce, possono essere considerate come una forma di energia radiante che si propaga con velocità c e sono ascrivibili a onde o particelle. Nel primo caso sono interpretate come un fenomeno oscillatorio (che si ripete periodicamente nello spazio e nel tempo) costituito da una componente elettrica ed una magnetica perpendicolari tra loro. lunghezza d’onda (l): distanza tra due punti in concordanza di fase. frequenza (n): numero di oscillazioni (cicli) compiute nell’unità di tempo. Poiché c = ln, l e n sono inversamente proporzionali Planck:le radiazioni luminose vengono emesse dalla sorgente in unità discrete: quanti o fotoni. Interpretando la radiazione elettromagnetica come particelle o fotoni (con i quali si spiegano le interazioni con la materia) si associa ad essa una quantità definita di energia E (appunto il fotone), proporzionale alla frequenza: (h = 6.6 · 10-27 erg · sec) E = hn per cui l’energia della radiazione aumenta all’aumentare di n e diminuisce all’aumentare di l. Quando un fascio di luce incidente colpisce una sostanza o una soluzione, una parte di radiazione è riflessa, un’altra è trasmessa e un’altra è assorbita. La parte assorbita, di diversa l e quindi di diversa E, dà luogo a specifiche interazioni con le molecole modificando in modo diverso il loro contenuto energetico. Perché avvenga l’assorbimento, l’energia del fotone deve eguagliare la differenza di energia tra lo stato fondamentale della sostanza assorbente e uno dei suoi livelli energetici eccitati. Nei composti ORGANICI l’assorbimento UV-vis avviene per transizioni elettroniche tra orbitali molecolari popolati e orbitali vuoti. Le più comuni transizioni energetiche sono: Transizioni s s * : Non si osservano nella regione UV-vis: sono necessarie radiazioni con l > 150 nm Queste transizioni corrispondono alle energie di rottura dei legami C-C, C-H, C-O, C-X... Transizioni n p * e p p * Per composti insaturi; ad es. composti con doppi e tripli legami e aromatici. Questi assorbimenti cadono nella regione tra 200-700 nm e sono molto intensi. s* anti-legame p* anti-legame n non-legame p s legame legame In presenza di doppi legami coniugati, si verifica una delocalizzazione elettronica con conseguente diminuzione energetica tra un livello e l'altro: per queste transizioni occorreranno radiazioni a l minore quali ad esempio quelle nel campo visibile. Si hanno spettri nell’UV/VIS (l = 200 - 780 nm) quando avvengono transizioni di elettroni esterni della molecola, sia impegnati sia non impegnati in legami. Gli elettroni in gioco sono soprattutto quelli delocalizzati, ad esempio quelli p in un doppio legame C=C. Si definisce cromoforo la parte della molecola che ha un caratteristico picco di assorbimento. L’energia necessaria alla transizione diminuisce nel caso di doppi legami coniugati e aumenta così la lunghezza d’onda di assorbimento del cromoforo. Ogni sostanza presenta quindi un suo caratteristico spettro di assorbimento ASSORBIMENTO: Supponiamo di avere un soluto assorbente in un solvente non assorbente, attraversato da luce monocromatica I0 I I < I0 Legge dell’assorbimento La legge che descrive i fenomeni di assorbimento è la legge di Lambert-Beer: A = abc dove A è l’assorbanza, “b” il cammino ottico, “c” è la concentrazione e “a” è un coefficiente che dipende dalla concentrazione e dalla lunghezza d’onda.
Scarica