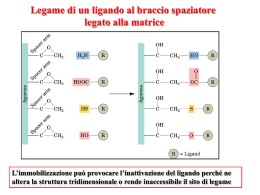
STUDIO DELLE PROTEINE cromatografia Frazionamento Metodi non meccanici: : centrifugazione Chiarificazione dell’estratto • L’estratto grezzo deve essere “pulito” prima di procedere al frazionamento • Conviene allontanare subito gli acidi nucleici, ribosomi mediante precipitazione (protamina solfato) • Nel caso contiene molto materiale insolubile si può centrifugare • Molto efficaci sono le tecniche che sfruttano la diversa solubilità delle singole proteine Sviluppo passaggi di purificazione • Solubilità differenziale m= 1/2SciZ2i METODI DI PRECIPITAZIONE DELLE PROTEINE • Punto isoelettrico • Calore • Precipitazione frazionata con Sali (salting-in/salting out) • Solventi organici • Con polimeri organici (PEG) • pH estremi Esempio di precipitazione frazionata • Sviluppo di passaggi cromatografici • Per stabilire la tecncica cromatografia più utile per la nostra proteina bisogna tenere conto di alcuni parametri generali: -la capacità e la resa del processo cromatografico; -la diluizione della proteina nel passaggio cromatografico; -la velocità, -la conservazione dell’attività durante il passaggio; -il costo dell’intero processo. Criterio generale: assemblare una serie di passaggi che separano le proteina secondo proprietà diverse. Concentrazione per ultrafiltrazione e conservazione • La concentrazione si realizza forzando acqua e piccole molecole attraverso una membrana semipermeabile usando alta pressione o centrifugazione. • • Sono disponibili commercialmente diverse membrane con intervallo di peso molecolare tra 500 e 300.000 (Amcon, Millipore) con dimensioni di pori 0,1-10 mm. • Le proteine purificate in genere vengono conservate a basse temperature (-80°C). Spesso si aggiungo agenti criogeni (glicerolo, glicole etilenico, DMSO) per stabilizzare la proteina durante il congelamento e scongelamento. Dialisi
Scarica





![qui - home - [direzione didattica 3° circolo sesto fiorentino]](http://s2.diazilla.com/store/data/000020926_1-ec417e9684a3c42e3aeda6d1402c5202-260x520.png)