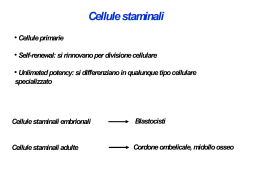
CORSO DI LAUREA SPECIALISTICA IN BIOTECNOLOGIE DEL FARMACO AA 208-09 Adriana Maggi LEZIONE 10 Ingegneria animale I ANIMALE TRANSGENICO: • animale nel cui genoma e’ stato introdotto un frammento di DNA esogeno TRANSGENE • frammento di DNA esogeno integrato stabilmente nel patrimonio genetico di cellule animali o vegetali METODI DI INGEGNERIA ANIMALE 1 Iniezione di DNA esogeno nella cellula uovo (TRANSGENESI STANDARD) 2 Ingegneria di cellule staminali in coltura e loro iniezione in blastocisti (GENE TARGETING) 3 Enucleazione della cellula uovo e inserzione di un nucleo di una cellula somatica (CLONAZIONE) TRANSGENESI STANDARD Microiniezione del DNA clonato zigote Embrione stadio 2 cellule Impianto nella femmina pseudogravida 10-20% dei nascituri contiene il transgene GENE TARGETING Trasfezione del DNA clonato in cellule ES Iniezione delle cellule staminali nella blastocisti Impianto della blastocisti in femmina pseudogravida Topo chimerico Ibrido F1 25-75% della progenie portano il transgene CLONAZIONE Pecore con muso giallo Pecore con muso nero Oocita enucleato Cellula somatica con nucleo Trasferimento del nucleo nell’oocita Impianto nella pecora Nascita della pecora dal muso giallo METODI DI INGEGNERIA ANIMALE Transgenesi standard SCOPO -GUADAGNO DI FUNZIONEesprimere un gene esogeno (transgene) in uno o piu’ tessuti dell’animale. (Eccezionalmente si puo’ avere perdita di funzione dovuta alla integrazione del transgene in una sequenza codificante.) Preparazione oociti fecondati Preparazione ‘pseudo pregnant’ Transgenesi standard METODO nel dettaglio microiniezione Preparazione costrutti Screening della progenie Preparazione oociti fecondati Cocktail ormonale Incrocio Recupero uova fecondate Preparazione del costrutto Purificazione del transgene propagazione del transgene transgene Vettore di clonaggio Preparazione delle ‘pseudo pregnant’ Femmina Maschio vasectomizzato Incrocio Impianto degli oociti microiniettati Microiniezione e reimpianto degli oociti microiniettati Prelievo delle uova fecondate Microiniezione Trasferimento delle uova fecondate microiniettate con il gene di interesse nell’utero di femmina pseudogravida Screening della progenie Analisi del DNA estratto dalle code della progenie per : PCR Southern blot Tecniche utilizzate per la verifica del genotipo Southern Blot Tecniche utilizzate per la verifica del genotipo Polymerase chain reaction Ciclo di base Amplificazione Incroci per l’omozigosi Founder/wild type F1/F1 F2 Omozigoti 1:4 Eterozigoti 1:2 Wild type 1:4 Transgenesi standard - riepilogo procedura - • microiniezione del transgene negli oociti fecondati • impianto nella femmina pseudogravida • gravidanza e nascita dei ‘Founder’ • Screening dei ‘founder’ • incroci successivi per ottenere l’animale omozigote METODI DI INGEGNERIA ANIMALE Transgenesi standard Destino del DNA dopo la microiniezione • integrazione stabile nel genoma della linea germinale dell’animale • integrazione in singola copia o con maggior frequenza in copie multiple distribuite secondo un tipico arrangiamento ‘in tandem’ • integrazione nel genoma in posizione casuale tramite RICOMBINAZIONE NON OMOLOGA METODI DI INGEGNERIA ANIMALE Gene targeting SCOPO -PERDITA DI FUNZIONEablare un gene endogeno attraverso l’inserzione mirata di un transgene GENE TARGETING Trasfezione del DNA clonato in cellule ES Iniezione delle cellule staminali nella blastocisti Iniezione delle cellule staminali nella blastocisti Topo chimerico Ibrido F1 25-75% della progenie portano il transgene GENE TARGETING - procedura - • generazione di cellule staminali (Embryonic Stem cells o cellule ES) • preparazione del vettore • trasfezione delle cellule ES con il vettore • iniezione delle cellule trasfettate nella blastocisti • generazione di topi mosaico • incroci successivi per ottenere l’animale con il transgene nella linea germinale Generazione di cellule staminali ES Blastocisti Femmine dopo 3-4 giorni dal concepimento Espianto e messa in coltura Crescita in terreno selettivo per le ES Disaggregazione 1 passaggio Linea pura Trasfezione delle ES Trasfezione del vettore (elettroporazione) Selezione delle cellule knock out Cellule ES Strategia di selezione delle ES knock out Destino del DNA Integrazione sito specifica Integrazione random Frequenza: Omologa/non omologa = 1/1000 Ricombinazione omologa Es. di gene targeting Verifica del genotipo Southern blot PCR Iniezione delle cellule ES nella blastocisti - generazione di animali mosaico - Incroci per l’omozigosi Founder/wild type F1/F1 F2 Omozigoti 1:4 Eterozigoti 1:2 Wild type 1:4 METODI DI INGEGNERIA ANIMALE Gene targeting Destino del DNA dopo la microiniezione • integrazione stabile nel genoma della linea germinale dell’animale • integrazione in singola copia • integrazione nel genoma in un sito specifico tramite RICOMBINAZIONE OMOLOGA METODI DI INGEGNERIA ANIMALE Clonazione - procedura Il nucleo di cellule somatiche (ghiandola mammaria) arrestate nella fase G0 del ciclo cellulare e’ impiantato in un oocita enucleato nella metafase II della meiosi CLONAZIONE Pecore con muso giallo Pecore con muso nero Oocita enucleato Cellula somatica con nucleo Trasferimento del nucleo nell’oocita Impianto nella pecora Nascita della pecora dal muso giallo METODI DI INGEGNERIA ANIMALE Clonazione SCOPI • ottenimento di “gemelli” di un fenotipo di interesse • nuovo metodo di transgenesi possibilita’ di ingegnerizzare le cellule somatiche da cui si preleva il nucleo per il reimpianto METODI DI INGEGNERIA ANIMALE Riepilogo • transgenesi standard - guadagno di funzione • gene targeting - perdita di funzione • clonazione - generazione clonale di individui GENERAZIONE DI MUTANTI CONDIZIONALI Il sistema cre-loxP LoxP Gene bersaglio CRE RICOMBINASI LoxP GENERATION OF THE LID/ERE-Luc MOUSE LID (liver-specific IGF-I genedeficient) Esone 4 ERE-Luciferase Cre X Luciferase Albumin promoter Lox P ERE sequences X Ex 4 Luciferase CRE 80% plasma IGF-I LID/ERELuc APPLICAZIONI FARMACOLOGICHE DELL’INGEGNERIA ANIMALE • Studio di funzione genica (ricerca di base) • Modelli di patologia umana • Produzione di biofarmaci • Modelli per lo screening di farmaci Studi di funzione genica (ricerca di base) Es. Knock-out dei recettori per le lipoproteine a bassa densita’ e implicazione nei meccanismi patogenetici di insorgenza dell’aterosclerosi Transgenici per i ligandi dei recettori sopracitati (ApoE e ApoB) e implicazione nei meccanismi patogenetici di insorgenza dell’aterosclerosi Modelli di patologia umana Utilizzi in farmacologia • studio dei meccanismi patogenetici e identificazione di nuovi bersagli farmacologici • test dell’attivita’ farmacologica di composti Modelli di patologia umana • Malattie virali • Malattie ereditarie • Malattie neoplastiche Per approfondimenti Bedell et al. Genes & Development (1997) 11: p. 11-43 Modelli di malattie virali virus umani spesso non infettano altri mammiferi Si generano modelli transgenici Es. Papovavirus JC responsabile della leucoencefalopatia multifocale sviluppo di una patologia simile nel topo transgenico per il virus Modelli di malattie ereditarie monogeniche • Es. Transgeenico per l’huntightina mutata provoca la malattia di Huntighton nel topo Goldberg, Y. et al., Absence of disease phenotype and intergenerational stability of the CAG repeat in transgenic mice expressing the human Huntington disease transcript. Hum. Molec. Genet. 5: 177-185, 1996. PubMed ID : 8824873 • Es. Knock out per il cluster genico della beta-globina provoca beta-talassemia nel topo Ciavatta, D. J.; Ryan, T. M.; Farmer, S. C.; Townes, T. M. : Mouse model of human beta-0-thalassemia: targeted deletion of the mouse beta(maj)- and beta(min)-globin genes in embryonic stem cells. Proc. Nat. Acad. Sci. 92: 9259-9263, 1995. PubMed ID : 7568113 Modelli di malattie neoplastiche Es. Mutazioni nel gene che codifica per APC (ADENOMATOUS POLYPOSIS OF THE COLON) predispongono ai tumori del colon. La mutazione introdotta per gene targeting anche nel topo provocainsorgenza di tumori intestinali. Produzione di biofarmaci Utilizzo di vettori tessuto specifici per esprimere proteine terapeutiche nel latte o nel siero di animali transgenici Modelli per lo screening di farmaci • Topo Transgenico ERE-Luciferasi Modello per lo screening di farmaci attivi sul recettore degli estrogeni. SCREENING OF COMPOUNDS MODULATING ERs ACTIVITY CMV ER cDNA SERMS trascrizione ER traduzione Luciferasi ER RNA pol Attivazione di ER tra ER trascrizione Co-Fact. NO trascrizione ERE prom. LUCIFERASI RNA pol ER ER ERE prom. LUCIFERASI Strategia per la generazione del topo reporter ER-luc INTERESSE FARMACOLOGICO DEGLI ESTROGENI • (Malattie neurodegeneragive) • Terapia endocrina dei tumori • (Rischi cardiovascolari) • Controllo della ferilita’ Disfunzioni endocrine • Prevenzione dell’osteoporosi LUCIFERASE EXPRESSION IN LIVER AND BONE TIME DOSE 250 200 20 10 0 0h E2 3h 6h 16h 300 fold induction fold induction fold induction 250 LIVER ANTAGONISTS 150 0 E2 200 ° 50 25 ° * 0 0 0.5 5 50 250 20 10 E2 0 0h 3h 6h 16h 30 fold induction 30 fold induction BONE fold induction (mg/Kg) 20 10 0 E2 0 0.5 5 50 250 (mg/Kg) 30 20 10 0 * ° ° IMAGING OF ESTROGENIC ACTIVITY 0h pharmacological treatment with E2 3h 24h 6h 6h CYCLING FEMALES 400 PROES. ESTR. DIEST. 120 LIVER BONE 80 200 40 0 0 200 300 OVARIES BRAIN 200 100 100 0 E D-1 D-2 P P E D Estradiol (pg/ml) DIEST.-1 E D-1 D-2 P DIEST-2 PROEST. ESTRUS 13 13 13 50 25 0 13
Scarica