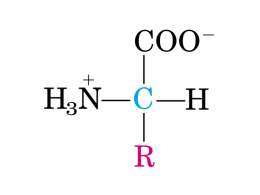
Amminoacidi: classificazione e proprietà LE 4 CLASSI DI AMMINOACIDI: 1- Amminoacidi con catena laterale apolare o idrofobica 2- Amminoacidi con catena laterale polare, priva di carica netta 3- Amminoacidi con catena laterale con carica positiva 4- Amminoacidi con catena laterale con carica negativa • le strutture chimiche e le potenzialità di legame delle catene laterali dei singoli amminoacidi; • i codici mono e triletterali • le ammine biogene Agenti secretagoghi: le ammine biogene Agenti secretagoghi: le ammine biogene Adrenalina Noradrenalina Dopamina Rilasciate dalle ghiandole surrenali in situazioni di stress, come stress psicologico o cali di glicemia. Agenti secretagoghi: le ammine biogene Agenti secretagoghi: i peptidi Agenti secretagoghi: i peptidi Precursore 1 della guanilina di Homo sapiens 1 MNAFLLSALC LLGAWAALAG GVTVQDGNFS 40 FSLESVKKLK DLQEPQEPRV GKLRNFAPIP GEPVVPILCS NPNFPEELKP LCKEPNAQEI LQRLEEIAED PGTCEICAYA ACTGC 115 Guanilina biologicamente attiva guanilina (corrisponde al C-terminale del precursore 1 15 PGTCEICAYA ACTGC i peptidi Agenti secretagoghi: La gastrina si presenta in due forme: i) la “grande gastrina”, costituita da 34 residui amminoacidici (G-34), che viene idrolizzata a formare la “piccola gastrina” di 17 residui amminoacidici. In realtà la parte attiva è costituita dai 5 residui Cterminali: GWM DF- NH2. In realtà, la pentagastrina è un prodotto di sintesi (nome commerciale Peptavlon): N-(isobutoxicarbonil)-beta-alanil-L-triptofanyl-Lmetionil-L-alpha-aspartil L-Fenilalanilammide. La gastrina umana è una proteina di 101 residui amminoacidici. Viene poi processata per dare le forme biologicamente attive. Human gastrin 34 1 MQRLCVYVLI FALALAAFSE ASWKPRSQQP DAPLGTGANR DLELPWLEQQ GPASHHRR 59 92 GlpL GPQGPPHLVA DPSKKQGPWL EEEEEAYGWM DF- NH2 Piroglutammico C-teminale amidato 101 GRRSAEDE N Piroglutammico EMBO J. 1995 Jul 3;14(13):3073-9. Tyrosine O-sulfation promotes proteolytic processing of progastrin. Bundgaard JR, Vuust J, Rehfeld JF. Source Department of Clinical Biochemistry, State University Hospital, Copenhagen, Denmark. Abstract Tyrosine O-sulfation is a common post-translational modification of secretory and membrane proteins. The biological function of sulfation is known in only a few proteins, where it appears to enhance protein-protein interactions. Based on known sequences around sulfated tyrosines, a consensus sequence for prediction of target tyrosines has been proposed. However, some proteins are tyrosine sulfated at sites that deviate from the proposed consensus. Among these is progastrin. It is possible that the deviation explains the incomplete sulfation characteristic for bioactive gastrin peptides. In order to test this hypothesis, we have performed site-directed mutagenesis of the gastrin gene followed by heterologous expression in an endocrine cell line. The results show that substitution of the alanyl residue immediately N-terminal to the sulfated tyrosine with an acidic amino acid promotes the sulfation of gastrin peptides. Hence, the study supports the proposed consensus sequence for tyrosine sulfation. Importantly, however, the results also reveal that complete sulfation increases the endoproteolytic maturation of progastrin. Thus, our study suggests an additional function for tyrosine sulfation of possible general significance. Membrane luminali e controluminali Il trasporto di soluti può essere di tipo trans-cellulare o para-cellulare
Scarica